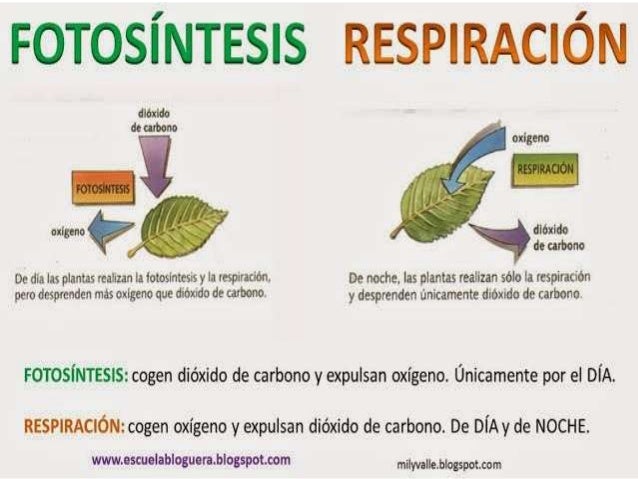
Fotosíntesis: proceso mediante el cual los organismos que contienen clorofila utilizan luz solar, dióxido de carbono (CO2) y agua (H2O), para producir su propio alimento y liberar oxígeno.
Cloroplastos: son células que se encuentran en las hojas y gracias a ellas ocurre el proceso de fotosíntesis.
- Clorofila: contenida en los cloroplastos. Contienen un pigmento de color verde que absorbe la energía del sol.
Importancia de la fotosíntesis
Los productos de la fotosíntesis aportan la energía que las plantas necesitan para crecer y reproducirse. Así pueden formar parte de la alimentación de herbívoros, con sus hojas, frutos, flores y tallos. Los herbívoros son alimento de carnívoros y éstos de otros animales, los que forma la cadena alimentaria; siendo las plantas el primer escalón en este ciclo.
Además de la producción de oxígeno que es necesario para la respiración en el planeta.
Pasos de la fotosíntesis:
1. El agua llega a las hojas desde la raíz.
2. La clorofila contenida en los cloroplastos absorbe la luz solar.
3. El dióxido de carbono en el aire entra en las hojas.
4. La clorofila activada por la luz solar, transforma el agua y el dióxido de carbono en glucosa y oxígeno.
5. El oxígeno se libera a la atmósfera.
Durante la fotosíntesis se produce:
1. Carbohidratos o azúcares: como la glucosa y fructosa, que forman parte de la savia elaborada y se transporta a toda la planta. Las plantas almacenan el exceso de estos azúcares en forma de almidón.
2. Oxígeno: se libera oxígeno a la atmósfera. Gracias a este gas es posible la vida de muchas plantas, animales y humanos.
Almacenamiento de nutrientes.
Las plantas almacenan el almidón en las hojas, los tallos verdes, las raíces gruesas y las semillas. Ejemplo: ñame, ocumo, yuca, zanahoria, papa…
Respiración de las plantas:
Se utiliza el oxígeno para descomponer los nutrientes y producir energía.
Mitocondrias: estructura de las plantas donde se realiza la respiración.
Fases:
1. Intercambio de gases: las células captan oxígeno y liberan CO2.
2. Liberación de energía: ocurre en las mitocondrias. El oxígeno actúa sobre los nutrientes, liberando energía y CO2 este último se expulsa en el “intercambio de gases”.
Estructuras respiratorias de las plantas:
1. Estomas: se encuentran en el envés de la hoja, formados por células con forma de salchichas, que al hincharse dejan un espacio entre ellas que permite el intercambio de gases.
2. Lenticelas: son aberturas que se encuentran principalmente en tallos y raíces.
Relación entre respiración y fotosíntesis:
Durante la fotosíntesis se usa energía solar para combinar dióxido de carbono y agua con el fin de producir glucosa y oxígeno. Éste último elementos es usado en el proceso de respiración para oxidar la glucosa y liberar dióxido de carbono y agua que son necesarios en la fotosíntesis. Es decir, uno complementa al otro manteniendo el equilibrio ambiental.
CUESTIONARIO:
1º. ¿En qué consiste el proceso de fotosíntesis?
La fotosíntesis es un proceso que transforma la energía de la luz del sol en energía química. Consiste básicamente en la elaboración de azúcar a partir del CO2, minerales y H2O con la ayuda de la luz solar.
2º. ¿Por qué los musgos presentan falsas raíces, falsos tallos y falsas hojas?
Porque los musgos carecen de un tejido conductor y entonces el agua para ascender ha de pasar de célula en célula y, por tanto, al no presentar vasos conductores de savia se les apodan como “falso”.
3º. ¿Qué diferencia hay entre las plantas angiospermas y gimnospermas?
La diferencia entre una planta gimnosperma y otra angiosperma es que en la gimnosperma su semilla no está encerrada en un fruto (coníferas) y en las angiospermas su semilla sí está encerrada en un fruto.
4º. Además de aguas y sales minerales, ¿qué necesitan las plantas para realizar la fotosíntesis?
Además de agua y sales minerales las plantas necesitan dióxido de carbono y luz solar.
5º. ¿De qué está formada la savia bruta?
La savia bruta está formada de minerales que se mezclan con el agua absorbida por la planta.
6º. ¿Por dónde asciende la savia bruta hasta llegar a las hojas?
La savia bruta asciende por el interior de los vasos leñosos denominados xilema.
7º. ¿Es igual el proceso de fotosíntesis que el de la respiración? ¿Por qué?
No, porque la fotosíntesis consiste en transformar la materia inorgánica en materia orgánica y usar la energía química estable, resultado de este proceso, para la sustentación de la planta, mientras, que la respiración es el intercambio de gases entre la planta y la atmósfera.
A diferencia de la fotosíntesis en la respiración, las plantas toman O2 de la atmósfera y expulsan CO2 y agua en forma de vapor.
Además el proceso fotosintético sólo se realiza durante el día, al contrario que la respiración, que se realiza durante todo el día.
8º. ¿Qué hacen las plantas cuando transpiran?
Al transpirar la planta pierde agua en forma de vapor.
9º. ¿A quién perteneció la tablilla con 61 plantas que ahora está en el museo británico?
Perteneció a Merodach Baladán.
10º. ¿Quién enviaba a Aristóteles especies raras de animales y plantas para aumentar su colección?
Alejandro Magno.
11º. ¿Qué hacía Aristóteles cuando recibía especies raras de plantas?
Las dividía por especies, con flores y sin flores.
12º. ¿Cuáles son los dos tipos de opciones que tiene el ser humano para alimentarse de frutas y verduras?
Directa e indirecta.
13º. ¿Para qué se utilizan las plantas además de para alimentarnos de ellas?
Se utilizan como elemento decorativo, para el comercio, por ejemplo, en las industrias textiles, proporcionan O2 a la atmósfera, se emplean para la drogadicción, hobbies del ser humano y para la medicina.
14º. .¿Que es la respiración?
''La respiración se refiere al proceso mediante el cual las plantas toman oxígeno y desprenden dióxido de carbono. Ambos procesos son inversos.''




















.jpg)